Інтравезикальні інстиляції високомолекулярного гіалуронату натрію при радіаційному циститі: проспективне пілотне дослідження
Michael Baboudjian(1) · Marc Fourmarier(2) · Christophe Clement(3) · Arnaud Cherasse(4) · Jean‑Pierre Graziana(5) · Youssef Bentaleb(6) · Yohann Rouscoff(7) · Sylvain Ducrocq(8) · Bastien Gondran‑Tellier(1) · Christian Saussine(9) 1) Відділення урології та трансплантації нирки, лікарня La Conception, Університет Екс-Марсель, APHM, Марсель, Франція 2) Відділення урології, лікарня CH Aix-Pertuis, Екс-ан-Прованс, Франція 3) Відділення урології, клініка Рон Дюранс, Авіньйон, Франція 4) Відділення урології, клініка Валь д'Уест, Екюлі, Франція 5) Відділення урології, клініка Mutualiste de la Porte de L'Orient, Лор'ян, Франція 6) Відділення урології, лікарня CH Jean Rougier, Каор, Франція 7) Відділення урології, клініка Сен-Жорж, Ніцца, Франція 8) Відділення урології, лікарня CH Notre Dame de la Miséricorde, Аяччо, Франція 9) Відділення урології, NHC, Університетська клініка Страсбурга, Страсбург, Франція
Анотація
Мета: Оцінити ефективність та безпечність інтравезикальних інстиляцій високомолекулярної гіалуронової кислоти (ВМГК) для лікування радіаційного циститу.
Методи: Це проспективне когортне дослідження було проведено в семи центрах у Франції. Набір відповідних пацієнтів із радіаційним циститом здійснювався у період з квітня 2020 р. до березня 2021 р. Щодня виконували інстиляції у сечовий міхур стерильного одноразового попередньо наповненого розчину об’ємом 50 мл, що містив 0,16 % (80 мг/50 мл) ВМГК (ІНСТІЛАН). Курс лікування складався з 6 сеансів (від V1 до V6).
Кінцеві точки оцінювали через 1 тиждень (V7) і 4 тижні (V8) після останнього сеансу та порівнювали з початковим рівнем (V0). Первинною кінцевою точкою був біль у сечовому міхурі, який оцінювали за допомогою опитувальника з 5 стереотипними варіантами відповіді. Вторинні кінцеві точки включали зміни порівняно з початковим рівнем гематурії, частоти сечовипускання та впливу імперативних позивів до сечовипускання на якість життя (ЯЖ). Небажані явища (НЯ) ранжували відповідно до класифікації CTCAE 3.0.
Результати: Для участі було зареєстровано загалом 30 учасників. Аналіз усіх рандомізованих пацієнтів показав значне зниження інтенсивності тазового болю (-45,81 %, p<0,001), гематурії (-26,87 %, p= 0,008), загальної кількості сечовипускання за 24 години (-23,92 %, p<0,001) та впливу імперативних позивів до сечовипускання на ЯЖ (-33,92 %, p<0,001) під час візиту V7. У період між V7 і V8 після завершення лікування і надалі спостерігалися результати, досягнуті для кожної кінцевої точки. Було зафіксовано добру переносимість інтравезикальних інстиляцій: повідомлялося про два НЯ (6,6 %), пов’язані з лікуванням, що являли собою гематурію 1-го ступеня важкості.
Результати: До дослідження було включено 30 пацієнтів. Аналіз за вибіркою «пацієнти, що мають намір лікуватись» показав істотне зниження ступеня тазового болю (- 45,81 %, р<0,001), гематурії (- 26,87 %, p<0,008), добового діурезу (- 23,92 %, p<0,001) та впливу позивів на якість життя (- 33,92 %, p<0,001) у точці V7. Поліпшення залишалося стабільним за кожним результатом після лікування в період між точками V7 та V8. Лікування внутрішньоміхуровими інстиляціями добре переносилося пацієнтами: повідомлялося про два (6,6 %) НЯ, пов’язані з лікуванням, які відповідали двом випадками гематурії 1 ступеня.
Результаты: В исследование были включены 30 пациентов. Анализ по выборке «намеренные лечиться» показал существенное снижение в выраженности тазовой боли (- 45,81%, р<0,001), гематурии (- 26,87%, p<0,008), суточном диурезе (- 23,92%, p<0,001) и влиянии позывов на качество жизни (- 33,92%, p<0,001) в точке V7. Улучшение оставалось стабильным по каждому результату после лечения в период между точками V7 и V8. Лечение внутрипузырными инстилляциям хорошо переносилось пациентами: сообщалось о двух (6,6%) НЯ, связанных с лечением, которые соответствовали двум случаям гематурии 1 степени.
Висновок: Інтравезикальні інстиляції ВМГК ефективні у лікуванні радіаційного циститу. Для підтвердження наших попередніх результатів потрібним є проведення подальших порівняльних досліджень із тривалішим періодом спостереження.
Ключові слова: Гіалуронат натрію, інтравезикальна інстиляція, радіаційний цистит, біль у сечовому міхурі, гематурія.
Ми хотіли б віддати данину пам’яті панові Франсуа Шутцу (Mr. Francois Schutz), голові «ЛІДДЕ Терапевтикс» (LIDDE Therapeutics).
Вступ
Зовнішня променева терапія малого тазу є важливим інструментом у терапевтичному арсеналі для лікування раку органів малого тазу [1]. Проте сечовий міхур є критичним органом, який може бути чутливим навіть до низьких доз опромінення. Попри удосконалення технік, опромінення органів малого таза і надалі є причиною розвитку гострих та / або відкладених небажаних явищ з боку сечовивідних шляхів.
Радіаційний цистит є стерильним циститом неінфекційного походження, що характеризується дифузною кровотечею зі слизової оболонки сечового міхура. Передбачувана частота радіаційного циститу в цій популяції, що зазнала опромінення, коливається від 5 до 20 % [2]. Симптоми включають біль у сечовому міхурі, гематурію, часте сечовиділення, імперативні позиви до сечовиділення та нетримання сечі, які знижують якість життя (ЯЖ) пацієнтів, при цьому з плином часу ситуація може погіршитися [3].
Лікування радіаційного циститу є складним завданням. Описано різні варіанти лікування [4]. Гіпербарична оксигенотерапія (ГБОТ) є найвивченішим варіантом лікування персистуальної або рецидивної клінічно значущої гематурії. Проте така терапія потребує проведення загалом від 30 до 40 сеансів протягом 8-тижневого періоду, при цьому часто виникають рецидиви [5, 6]. Було запропоновано альтернативні консервативні методи лікування, наприклад, інтравезикальні інстиляції гіалуронової кислоти [7].
ГК є компонентом шару глікозаміногліканів, який розташований у субепітеліальному шарі стінки сечового міхура у високих концентраціях. Інтравезикальна інстиляція високомолекулярної гіалуронової кислоти (ВМГК), препарату ІНСТИЛАН (INSTYLAN) (Діако Біофармасьютичі С.Р.Л., Трієст, Італія (Diaco Biofarmaceutici S.R.L., Trieste, Italy)), дозволяє створити в’язкопружну мембрану на поверхні слизової оболонки, захищає та сприяє регенерації ушкодженого уротелію [8, 9].
Мета дослідження полягала в отриманні додаткових даних про вплив інстиляцій ВМГК на симптоми радіаційного циститу.
Матеріали та методи
Дизайн та учасники дослідження
Це багатоцентрове проспективне когортне дослідження було проведено відповідно до правил належної клінічної практики та принципів Гельсінської декларації у період з квітня 2020 р. до березня 2021 р. Протокол дослідження та поправки були схвалені Комітетом із захисту особи: CPP Sud-Est VI—Clermont Ferrand. Набір пацієнтів здійснювався у семи центрах у Франції. Спонсор (компанія «ЛІДДЕ Терапевтикс САС» (LIDDE Therapeutics SAS)), КІО та компанія з обробки даних (Easy-CRF SAS) відповідали за загальне керування дослідженням та збір даних (єИРФ) у співпраці з головним дослідником, який провів статистичний аналіз разом з одним з авторів. Рукопис було підготовлено одним з авторів незалежно від компанії «ЛІДДЕ Терапевтикс САС».
Пацієнти мали право на участь, якщо вони відповідали таким критеріям, як вік ≥18 років та наявність відкладених симптомів (>1 року після променевої терапії) радіаційного циститу, спричиненого променевою терапією органів малого тазу. Критерії включення: біль у сечовому міхурі та мінімум ще один симптом з боку сечовивідних шляхів, тобто імперативні позиви до сечовипускання, гематурія або часте сечовипускання.
Попереднє пероральне лікування, наприклад приймання антихолінергічних препаратів, не було критерієм виключення, якщо таке лікування було припинено до включення до дослідження. Критерії виключення: неврологічний сечовий міхур, сакральна нейромодуляція, інфекція нижніх сечовивідних шляхів, об’єм залишкової сечі після сечовипускання >200 мл, клінічно значуще серцево-судинне захворювання протягом останніх шести місяців та продовження лікування, включно з ГБОТ, поповненням глікозаміногліканів, променевою терапією, брахітерапією або інстиляціями БЦЖ / мітоміцину С.
Протокол
Під час скринінгового візиту (V0) всі пацієнти пройшли огляд для перевірки критеріїв відбору. Усі учасники отримали інформацію у письмовому вигляді та підписали згоду на участь. Інстиляції у сечовий міхур виконували відповідно до вказівок, наведених в інструкції виробника (Діако Біофармасьютичі С.Р.Л., Трієст, Італія). Якщо коротко, процедура передбачає інстиляцію у сечовий міхур стерильного одноразового попередньо наповненого розчину об’ємом 50 мл, що містить 0,16 % (80 мг/50 мл) ВМГК (ІНСТИЛАН), за допомогою стерильного катетера Фолея розміром 14–16. Пацієнтів повідомили про необхідність утримувати розчин не менше ніж 1 годину. Курс лікування складався з 6 щотижневих сеансів (V1– V6). Підтримувальні процедури не були заплановані.
Показники
Показники оцінювалися пацієнтом (показник результату, що повідомлявся пацієнтом) та лікарем через 1 тиждень (V7) і 4 тижні (V8) після останнього сеансу і порівнювався з початковим рівнем (V0). Первинною кінцевою точкою був біль у сечовому міхурі, що оцінювався за допомогою опитувальника з 5 стереотипними варіантами відповіді, де 1 = відсутність болю, 2 = легкий біль, 3 = помірний біль, 4 = сильний біль і 5 = нестерпний біль.
Вторинні кінцеві точки включали зміни порівняно з початковим рівнем інших зареєстрованих симптомів з боку сечовивідних шляхів, таких як гематурія (1 = сеча жовтого кольору, 2 = сеча рожевого кольору і 3 = сеча червоного або коричневого кольору), частота сечовипускання, яку оцінювали за допомогою 24-годинного щоденника сечовипускання, та вплив імперативних позивів до сечовипускання на якість життя (1–3 за ВАШ: 1 = відсутність проблем / легкі проблеми, 2 = помірні проблеми, 3 = серйозні проблеми).
Побічні ефекти оцінювали під час щотижневих візитів та розглядали окремо як небажані явища (НЯ) і серйозні небажані явища (СНЯ). НЯ ранжували відповідно до класифікації Загальних термінологічних критеріїв небажаних явищ (CTCAE), редакція 3.0.
Статистичний аналіз
Для розрахунку розміру вибірки ми запропонували, що зменшення болю в сечовому міхурі становитиме 30–50 %, що ґрунтувалося на даних попереднього дослідження [10]. Використовуючи значення α=0,05, ми розрахували розмір вибірки на рівні n=16. З огляду на можливість передчасного припинення участі та відмінності в терапевтичній відповіді у різних дослідженнях, ми прагнули набрати не менше ніж 25 пацієнтів.
Аналізи ефективності та безпечності було проведено в популяції всіх рандомізованих пацієнтів (ITT) і в популяції пацієнтів, які відповідали вимогам протоколу (PP). У разі припинення лікування пацієнтом (через відсутність ефективності та розвиток побічних ефектів або з особистих причин) в ITT-аналізі застосовували метод перенесення даних останнього спостереження (LOCF). Описова статистика була проведена за доступними змінними.
Категоріальні змінні були подані як частота і відсоток (%), а неперервні змінні — як середнє значення та стандартне відхилення (SD). Зміни порівняно з початковим рівнем оцінювали за допомогою знакового рангового критерію Вілкоксона або t-критерію Стьюдента.
Закриття бази даних відбулося (Easy-CRF) 20 травня 2021 року. Статистичний аналіз було виконано з використанням R-версії 4.0.2 (R Foundation for Statistical Computing, Відень, Австрія). P-значення менше ніж 0,05 вважалося статистично значущим. Дослідження було зареєстровано в базі ClinicalTrials.gov за номером NCT04696666.
Результати
У період з квітня 2020 р. до березня 2021 р. в семи центрах у Франції для участі було зареєстровано загалом 30 учасників, які становили ITT-популяцію. Після виключення трьох пацієнтів, у яких не було болю в сечовому міхурі під час V1, та одного пацієнта, що вибув із дослідження після двох інстиляцій через гематурію 1-го ступеня, PP-популяція становила 26 пацієнтів. У таблиці 1 наведено початкові характеристики ITT-популяції. Середній вік становив 75 років (± 2,8), а 29 (96 %) із 30 пацієнтів були чоловіками.
Загалом у 87 % пацієнтів був біль у сечовому міхурі, у 46 % було зафіксовано важку гематурію, а середня загальна кількість сечовиділень за 24 години становила 12 (±1,2). Проблема імперативних позивів до сечовиділення мала помірний або серйозний вплив на ЯЖ 87 % учасників. Раніше жоден пацієнт не був госпіталізований через гематурію. Показанням до променевої терапії був рак передміхурової залоги у 29 випадках (96,7 %) та рак шийки матки в 1 випадку (3,3 %). Медіана часу від завершення променевої терапії до інстиляцій сечового міхура становила 2,3 (2–2,7) року.
Клінічні результати
Під час V7 в ITT-популяції спостерігалося значне зниження інтенсивності болю порівняно з початковим рівнем: 2,27 (±0,29) (V1) проти 1,23 (±0,20) (V7) (-45,81 %, p<0,001) (таблиця 2). Щодо вторинних кінцевих точок, то під час V7 було зафіксовано, що лікування сприяло значному поліпшенню гематурії та зменшенню впливу імперативних позивів до сечовипускання на якість життя (всі p<0,01 порівняно з початковим рівнем) (таблиця 2). Щоденники також підтвердили значне зниження загальної кількості сечовипускання за 24 години від початкового рівня до V7 [з 11,87 (±1,21) до 9,03 (±1,28)] сечовипускань , p<0,001).
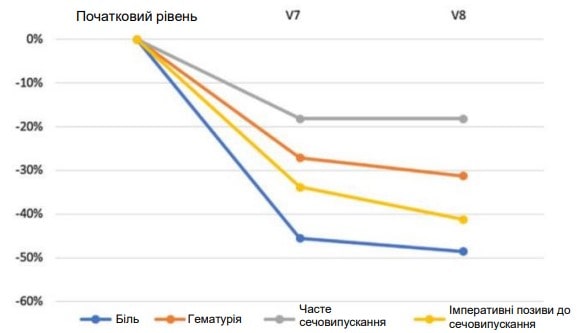
PP-аналіз показав аналогічні результати: показник болю в сечовому міхурі знизився з початкового середнього значення 2,46 (±0,27) (V1) до 1,19 (±0,18) наприкінці лікування (V7) із середньою відсотковою зміною -51,62 % (p<0,001). Це стосується й інших змінних, таких як гематурія (-34,54 %, p<0,001), кількість сечовипускань (-25,17 %, p<0,001) та часте сечовипускання (-37,44 %, p<0,001). У період між V7 і V8 після завершення лікування і надалі спостерігалися результати, досягнуті для кожної кінцевої точки, і фіксувалося певне поліпшення показників (рис. 1).
Таблиця 1. Початкові характеристики (ITT-популяція)

ЯЖ — якість життя
Безпека
Було зафіксовано добру переносимість трансуретральної катетеризації та інстиляції сечового міхура. Усього було зареєстровано два НЯ (6,6 %), пов’язані з лікуванням. Це були два випадки гематурії 1-го ступеня, що призвело до виключення одного пацієнта з дослідження. Жодному пацієнтові не потрібне було переливання крові. Не спостерігалося серйозних НЯ.
Таблиця 2. Клінічні наслідки
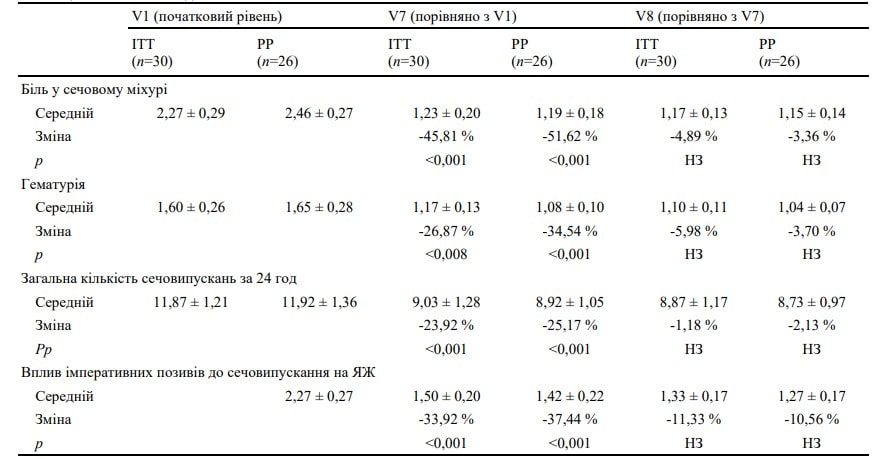
ЯЖ — якість життя, ITT— всі рандомізовані пацієнти, PP — пацієнти, які відповідали вимогам протоколу, НЗ — незначний, V7 — візит через тиждень після останньої інстиляції, V8 — візит через чотири тижні після останньої інстиляції
Рис. 1. Зміни показників від початкового рівня
Обговорення
Результати нашого багатоцентрового проспективного дослідження підтверджують, що інтравезикальні інстиляції ВМГК у пацієнтів із радіаційним циститом, спричиненим променевою терапією органів малого тазу, забезпечує значні клінічні переваги. Ми зафіксували значні поліпшення в популяціях ITT іPP за всіма кінцевими точками, що цікавлять, включно з болем у сечовому міхурі, гематурією, частим сечовипусканням та впливом імперативних позивів до сечовипускання на якість життя.
Було встановлено, що променева терапія органів малого тазу спричинює дефекти слизової оболонки сечового міхура, що призводить до хронічних запальних змін та затримки або запобігання загоєння уротеліальних клітин [11]. ВМГК — це нова інтравезикальна терапія, спрямована на відновлення захисного шару глікозаміногліканів, аби зменшити вплив сечі на нижчерозташовані епітеліальні клітини [12].
Наше пілотне дослідження підтверджує обнадійливі результати, отримані у попередніх дослідженнях відновної терапії з використанням ГК при різних захворюваннях, таких як інтерстиціальний цистит / больовий синдром сечового міхура [13-15], цистит, спричинений інтравезикальною імунохіміотерапією [16], геморагічний цистит після трансплантації гемопоетичних стовбурових клітин [17] та рецидивний бактеріальний цистит [18]. Отже, інноваційна життєздатна концепція інстиляцій ВМГК сприяє її ширшому використанню під час лікування радіаційного циститу.
На сьогодні ГБОТ є найвивченішим варіантом лікування персистуальної або рецидивної клінічно значущої гематурії. Результати численних досліджень підтверджують безпечність та ефективність ГБОТ, тому її слід розглядати як ранній варіант лікування радіаційного циститу у пацієнтів з явними симптомами. ВМГК порівнювали з ГБОТ в попередньому РКІ [10]. Пацієнтів у випадковому порядку розподілили по групах для отримання ВМГК (n = 16) і ГБОТ (n = 20). Через 6, 12 і 18 місяців після лікування учасники обох груп досягли схожих показників поліпшення.
Ці результати підтверджують результати нашого дослідження. Таким чином, тривалість відповіді, що спостерігається в нашій когорті через 4 тижні після останньої інстиляції, зберігається у середньостроковій перспективі. Водночас для визначення того, як довго триває дія ВМГК, потрібне довгострокове спостереження за нашою когортою.
Shao et al. також дійшли висновку про простіше введення та кращу переносимість інтравезикальної ГК порівняно з ГБОТ [10]. Справді, попри ефективність ГБОТ, цей метод лікування має кілька недоліків: пацієнти проводять 90 хвилин 5–7 днів на тиждень у гіпербаричній камері, вдихаючи 100 % кисень при тиску від 2 до 2,4 атмосфери; звичайна тривалість ГБОТ становить 40 процедур протягом 8-тижневого періоду [5]; вартість лікування досить висока, при цьому доступ до ГБОТ обмежений кількома експертними центрами.
Тому через значні вимоги до ресурсів та досвіду використання ГБОТ залишається обмеженим. І навпаки, ми підтвердили. що інтравезикальна інстиляція ВМГК є короткостроковим та легкодоступним варіантом лікування, що не потребує спеціальної технічної платформи. Для порівняння, ступінь впливу ВМГК на частоту сечовипускання аналогічний впливу антимускаринових препаратів, які протягом багатьох років застосовуються для лікування пацієнтів із нейрогенною гіперактивністю детрузора [20], показуючи багатообіцяючі результати. Інтравезикальне введення ГК також може чинити профілактичну дію.
У нещодавно опублікованому РКІ інстиляції гіалуронової кислоти і хондроїтинсульфату, що проводяться під час променевої терапії, забезпечили попередження розвитку симптомів з боку сечовивідних шляхів та поліпшення якості життя через 1 рік спостереження [21].
Було зафіксовано безпечність і добру переносимість інтравезикальних інстиляцій ВМГК. Було зареєстровано лише два незначні НЯ (6 %; 2/30). Ці ускладнення являли собою два випадки гематурії, що перебували під наглядом та залагодилися спонтанно. Наші результати вказують на переважаючу ефективність порівняно з іншими інтравезикальними методами лікування радіаційного циститу.
У нещодавньому дослідженні оцінювали інтравезикальне застосування солей алюмінію (галунів) у 40 пацієнтів із рефрактерним радіаційним циститом [22]. Після завершення періоду спостереження, медіана якого становила 17 місяців, тільки 13 пацієнтів (32,5 %) не потребували додаткового лікування, що поставило під сумнів тривалість ефекту цього методу. Крім того, повідомлялося про кілька випадків токсичності алюмінію в разі системної абсорбції у пацієнтів із нирковою недостатністю [23].
Подібним чином інтравезикальне введення формаліну, про яке вперше згадується 1973 року, при концентрації 10 % асоціюється з частими серйозними побічними ефектами [24]. Хоча було встановлено, що формалін ефективний для контролю гематурії, після лікування можуть виникнути серйозні ускладнення, включно з анурією, гідронефрозом, фістулами та септичною смертю [25, 26]. Інтравезикальна інстиляція ГК дозволяє розв’язати всі ці проблеми, тому що не спричинює серйозних НЯ.
Водночас слід визнати деякі потенційні обмеження цього пілотного дослідження. Основні обмеження стосуються включення лише однієї групи та невеликої кількості набраних пацієнтів. Аби підтвердити на більшій когорті ефективність ІНСТИЛАНУ в лікуванні радіаційного циститу, потрібно провести подальші порівняльні дослідження.
Тривалість відповіді, що спостерігається через 4 тижні після останньої інстиляції, була обнадійлива. На сьогодні триває річне спостереження за нашою когортою, щоб визначити, як довго триває дія ВМГК і чи потрібні повторні інстиляції. Зрештою, отримані результати оцінювали з використанням візуальної аналогової шкали, яка в цьому разі не є валідованим інструментом.
Висновки
Інтравезикальні інстиляції ВМГК ефективні у лікуванні радіаційного циститу. Для підтвердження наших попередніх результатів потрібним є проведення подальших порівняльних досліджень із тривалішим періодом спостереження.
Внесок авторів: Концепція та дизайн дослідження: MF. Збір даних: MF, CC, AC, J-PG, YB, YR, SD, CS. Аналіз та інтерпретація даних: MB, BG-T і MF. Підготовка рукопису: MB, MF і CS. Критичний перегляд рукопису щодо важливого інтелектуального змісту: MF і CS. Статистичний аналіз: BG-T.
Фінансування: Дослідження було проведено за фінансової підтримки компанії «ЛІДДЕ Терапевтикс САС».
Доступ до даних та матеріалів: Дані доступні на запит відповідному авторові.
Наявність кодів: Немає.
Заява
Конфлікт інтересів: Автори повідомляють про відсутність конфлікту інтересів.
Схвалення комітетом з питань етики: Протокол дослідження та поправки були схвалені Комітетом із захисту прав особи: CPP Sud-Est VI—Clermont Ferrand.
Згода на участь: Усі учасники отримали інформацію у письмовому вигляді та підписали згоду на участь.
Згода на публікацію: Всі автори схвалюють надання матеріалів.
Примітка видавця: Видавництво «Шпрінґер Нейче» (Springer Nature) зберігає нейтральну позицію щодо юридичних претензій в опублікованих картах та належності до певних установ.
Оригінал статті: https://doi.org/10.1007/s00345-021-03837-9
Перед застосуванням препаратів, запропонованих на даному інформаційному ресурсі, рекомендується проконсультуватися з лікарем, а також ознайомитися з інструкцією.
Інформація про виріб медичного призначення для професійної діяльності фахівців в області охорони здоров'я. INSTYLAN (ІНСТІЛАН) 0,16% безбарвний, прозорий, в'язкий гель гіалуронової кислоти нетваринного походження, стерильний, з фізіологічним рН.
INSTYLAN 0,16% схвалений в якості ІІa класу виробу медичного призначення. Сертифікат відповідності ЄС. Реєстраційний номер: DD 60107286 0001. Виробник: ТОВ «Юрія-Фарм», Україна, 03680, м. Київ, вул. М. Амосова, 10.

